光系统II(Photosystem II,PSII)是位于放氧光合生物类囊体膜上的一个重要膜蛋白质机器,它利用光能将水裂解为质子和电子,并放出氧气。具有光合放氧功能的PSII核心复合体是一个由20个蛋白亚基(17个跨膜蛋白和3个外周蛋白)、锰簇、非血红素铁、色素、质体醌(QA和QB)分子等多个辅助因子组成的色素膜蛋白复合体。
PSII在体内的组装和受到光损伤后的修复是一个由多种组装因子参与调控,通过形成不同的中间复合体来完成的复杂而高度有序的过程。Psb28是PSII的组装因子之一,在高温胁迫条件下,对维持PSII的放氧活性起着重要作用,敲除该基因的水稻植株会呈现浅绿的表型。然而,长期以来Psb28调控PSII组装修复的精确机制仍不清楚。
中科院植物所光合膜蛋白结构生物学研究团队与清华大学隋森芳研究团队合作,利用单颗粒冷冻电子显微镜技术解析了嗜热蓝藻(Thermosynechococcus vulcanus)PSII中间复合体Psb28-RC47和Psb28-PSII的近原子分辨率(3.14埃)三维结构,揭示了Psb28的精确结合位点及复合体的结构特征。研究表明Psb28-RC47复合体含有14个蛋白亚基,包括3个核心大亚基(D1、D2、CP47)、11个小亚基(PsbE、PsbF、PsbH、PsbI、PsbL、PsbM、PsbT、PsbX、Psb28、Tsl0063和一个未知跨膜蛋白UTP);Psb28-PSII复合体比RC47复合体多了4个跨膜亚基(CP43、PsbK、Psb30和PsbZ);Psb28位于PSII的基质侧,与D1、D2和CP47结合;Tsl0063是一个跨膜螺旋蛋白,与D1、CP47、PsbH和PsbL相互作用,对于维持PSII核心亚基的结构和Psb28的结合有重要作用;UTP位于Tsl0063的外侧,与Tsl0063呈X形排列。与具有放氧功能PSII的结构相比,CP47的C端、D1的D-E loop和D2的D-E loop的结构发生明显变化,导致了QA、QB和非血红素铁结合位点构象及周围配位环境和氢键网络的改变;另外,该研究也进一步揭示了锰簇缺失情况下,其结合位点的结构特征。Psb28和Tsl0063诱导的构象变化可能有利于保护未成熟的PSII免受光损伤。基于结构信息,研究人员提出了Psb28参与调控PSII组装修复的模型,对于理解PSII组装修复及其调控机制具有重要意义。
该研究于2021年7月5日在线发表于国际期刊Nature Plants,植物所已毕业博士研究生肖亚男和清华大学博士研究生黄国强为论文共同第一作者,植物所研究员韩广业和中科院院士、清华大学教授隋森芳为共同通讯作者。中科院院士、植物所研究员匡廷云和研究员王文达等参与了该研究。研究工作得到了科技部国家重点研发计划、国家自然科学基金、中科院先导专项、中科院前沿科学重点研究计划以及青促会等项目资助,并得到中科院植物所公共技术服务中心和清华大学冷冻电镜中心技术支持。
文章链接:https://www.nature.com/articles/s41477-021-00961-7
(光合实验室供稿)
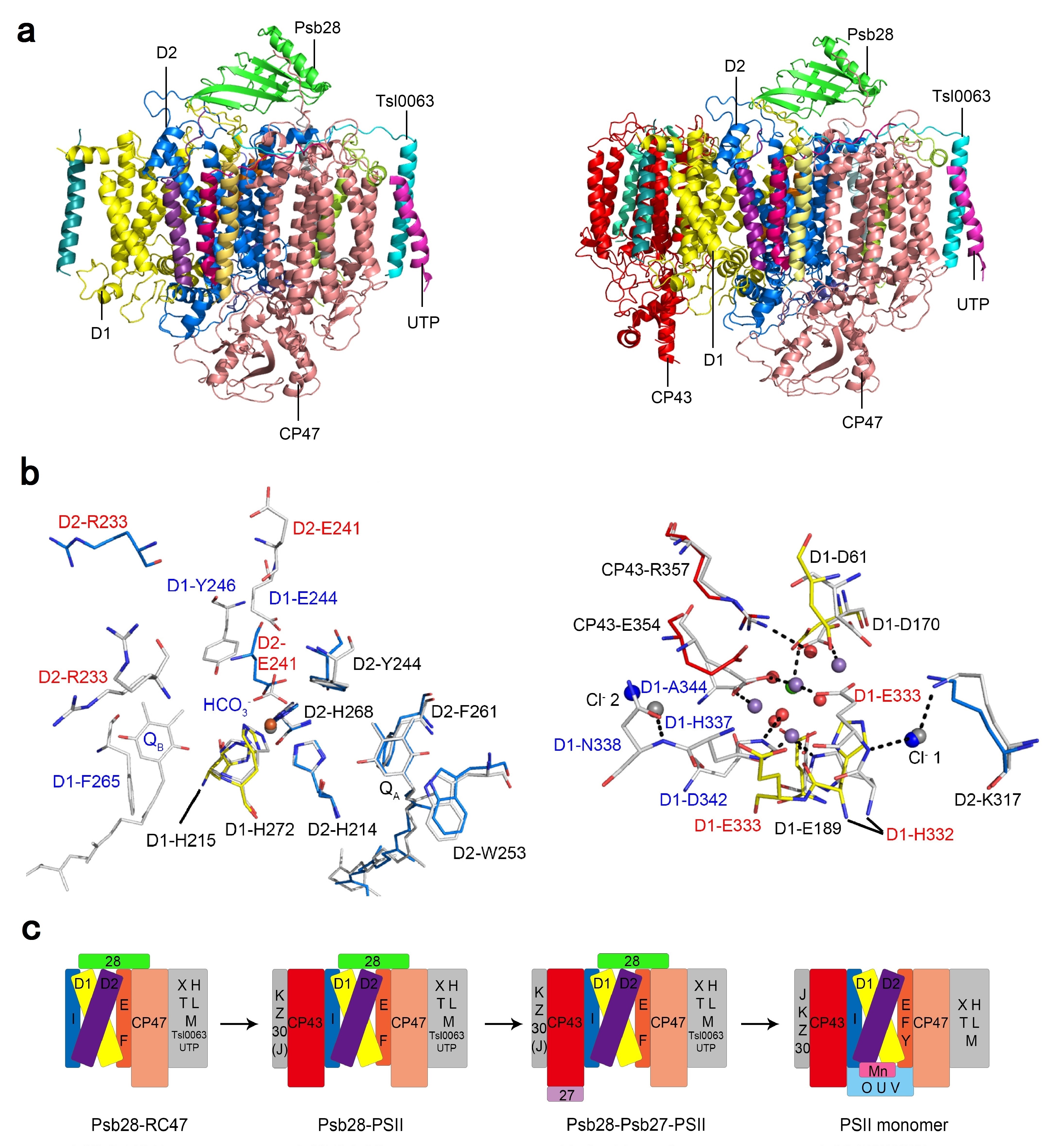
a,嗜热蓝藻(Thermosynechococcus vulcanus)PSII组装修复中间复合体Psb28-RC47和Psb28-PSII的结构及亚基组成;b,Psb28-PSII组装修复中间复合体中电子受体侧和给体侧的结构特征;c,Psb28参与的PSII组装修复模型。



